Kemolalan atau molalitas adalah jumlah mol zat terlarut dalam 1 (satu) kg pelarut. Fraksi mol adalah perbandingan jumlah mol zat terlarut atau pelarut dengan jumlah mol larutan. Kemolalan dan fraksi mol merupakan sifat koligatif larutan, yaitu sifat larutan yang tidak bergantung pada jenis zat terlarut melainkan hanya pada konsentrasi partikel terlarutnya.
- News
- _International1
- __The Power of Peace
- __Protecting Children
- __ COVID-19’s Long Tail
- __Journalist Safety
- __Protecting Children
- __Wonders of Rainforests
- __Apartheid - Genocide
- _International2
- __ Carbon Neutral Future
- __Geography of COVID-19
- __ Indigenous Rights
- __Global Engagement
- __Benefits of Diversity
- __Multilateralism
- __Biotechnological
- _Economy1
- __Likuiditas Aset
- __Bank/Kartu Lama
- __Pembayaran Digital
- __Ekonomi Digital
- __Mata Uang Digital
- __Efek Chatbot AI
- __Masalah Ekonomi
- _Economy2
- __Investasi Warga Lokal
- __Global Economy2
- __Global Economy1
- __Economic Ratings2
- __Economic Ratings1
- __Economic Landscape
- __World Economic Forum
- _Sosial1
- __Dampak Era Digital
- __Dampak Revolusi AI
- __Masalah Umum Sosial
- __Budaya Konsumtif
- __Pengabaian UU/Hukum
- __Budaya Korupsi Pejabat
- __Mengupas Konflik Teori
- _Sosial2
- __Budaya Perundungan
- __Ethnic Conflict
- __ Artificial Intelligence2
- __ Artificial Intelligence1
- __Social Media News
- __Intercultural Empathy
- __ Children’s Healthcare
- _Software
- __Geogebra
- __Operasi Sistem
- __System FreeBSD
- __Open Source
- __Popular Software
- __Computer Programs
- __Autocad Software
- Info
- _Politik1
- __Politik Identitas
- __Jenis Politik Indonesia
- __Politik dengan Bisnis
- __Boneka Partai Politik
- __Dampak Politik Uang
- __Politik Pecah Belah
- __Media Manipulatif
- _Politik2
- __Politik Demi kekuasaan
- __Sirkus Politik
- __Politik Instabilitas
- __Penggiringan Opini
- __Politik dengan Buzzer
- __Naratif Advokasi Iblis
- __Politik Kriminalisasi
- _Politik3
- __Politik Dinasti
- __Ukraine VS Rusia
- __Right/Left Wing
- __Iran vs Israel Update2
- __Iran vs Israel Update1
- __Power of Twitter.com
- __World War Updates1
- _Info1
- __Pollutant
- __Extraterrestrial Life
- __J. Robert Oppenheimer
- __ Education & Child Labor
- __Coronavirus Is Back
- __Visi Misi Capres
- __Ciri-ciri Berita Baik
- _Info2
- __Ciri-ciri Berita Hoaks
- __Daerah Wisata Lombok
- __Kabupaten 50 Kota
- __Berita Hangat
- __Dunia Jurnalistik
- __Wisata Madura
- __Wisata Sumenep
- _Info3
- __Naskah Berita Efektif
- __Berita & Berita Info
- __Bing atau Google?
- __Algoritma Bias
- __Berita Info 2023
- __Mengetik 10 Jari
- __Contoh Naskah Drama
- _SEO
- __Content VS SEO
- __Myths of SEO
- __SEO Tutorial
- __SEO Tutorial
- __White VS Black Hat SEO
- __SEO Best Tips
- __White Hat SEO
- Ilmu
- _Ilmu Pengetahuan
- __Mikroorganisme
- __Asam, Basa, Garam
- __Hujan Asam
- __Manfaat Madu
- __Bahan Kimia Dapur
- __Universitas Tertua
- __Fakta tentang Buaya
- _Sains1
- __Mystery in Science
- __Colloids
- __Pollutant
- __Tardigrade
- __Stimulus
- __Holobiont
- __Fosil Mantis
- _Sains2
- __Partikel Hantu
- __Kopling Katalisis
- __Nano Electrochemistry
- __Bosenova
- __Spiral Fibonacci
- __Jurasic Park
- __Turritopsis Dohrnii
- _Tutorial1
- __Mikrotik1
- __Mikrotik2
- __AMPHTML1
- __AMPHTML2
- __HTML Meta Tag
- __Usaha Modal Kecil
- __MySQL Cheat Seat
- _Tutorial2
- __ AMPscript
- __Tips Mendapat Kerja
- __ Linux Commands
- __ Windows Commands
- __Algorithms Structures
- __Tips Lulusan SMA/SMK
- __Cara Belajar Efektif
- _Inspirasi
- __Jual Beli Laptop
- __Usaha Komputer
- __Tips Usaha Maju
- __Kata-kata Mutiara
- __Sukses dalam Hidup
- __Memanfaatkan Sampah
- _Islami
- __Hidup Sederhana
- __Taqwa Kepada Allah
- __Menuntut Ilmu
- __Kecerdasan Anak
- __Dosa Jariyah
- __Tabayun/Tatsabut
- __Islam & Environment
- Trik
- _Trik Perkalian (1)
- __Trik Cepat Perkalian 6
- __Hafalan Perkalian 3,14
- __Trik Cepat Perkalian 50an
- __Trik Cepat Perkalian 18
- __Perkalian Notasi Ilmiah
- __Perkalian Dibawah 100
- __Trik Perkalian 100an
- _Trik Perkalian (2)
- __Perkalian 9 dengan 11-20
- __Perkalian Bilangan 90an
- __Trik Cepat Perkalian 25
- __Trik Cepat Perkalian 6
- __Trik Cepat Perkalian 9
- __Trik Cepat Perkalian 8
- __Trik Cepat Perkalian 13
- _Trik Pecahan (1)
- __Cara Mengurut Pecahan
- __Porogapit Desimal & Bulat
- __Perkalian Desimal
- __Trik Pembagian Desimal
- __Pembagian 5 jadi Desimal
- __Jumlah Penyebut Besar
- __Kurang Penyebut Besar
- _Trik Pecahan (2)
- __Trik Pecahan angka 9
- __Pec. antara 2 Pecahan
- __Operasi Hitung Campuran
- __Operasi Hitung Pecahan
- __Des. infinity beraturan
- __Pec. Biasa & Campuran
- __Pec. dg Akar & Pangkat
- _Trik Fisika 1
- __Mengubah Satuan Suhu
- __Ops. Angka Penting1
- __Ops. Angka Penting2
- __Bahasan Usaha & Daya
- __Kord. Titik Homogen
- __Hitung Kedalaman Laut
- __Tangan Kanan Lorentz
- _Trik Fisika 2
- __Ilusi Optik Menipu Mata
- __Hit. Besaran Mikroskop
- __2 Gabus Permukaan Air
- __Hidrostatis Ikan Akuarium
- __Kekuatan Lensa Kacmt.
- __Bayangan Cermin Cekung
- __Hitung Energi Potensial
- _Trik Fisika 3
- __Periode & Frek. Bandul
- __Grafik Transversal
- __Pelajaran Efek Doppler
- __Pelajaran Gerak Lurus
- __Pelajaran Suhu & Kalor
- __U. & Pesawat Sederhana
- __Energi & Daya Listrik
- Tips
- _Aritmatika 1
- __Macam2 Pola Bilangan
- __Penjelasan Lengkap
- __Barisan Aritmatika
- __Hitung Deret Aritmatika
- __Trik Barisan Aritmatika
- __Nilai Notasi Sigma
- __Visual Barisan Aritmatika
- _Aritmatika 2
- __Menentukan 3 Aritmatika
- __Rms suku ke-n Aritmatika
- __Akar Kuadrat & Kubik
- __Aritmtk. Bunga Majemuk
- __Ops. Aritmatika Fungsi
- __Aritmatika Kurva Elips
- __Aritm. & Aljabar Terpadu
- _Persamaan Kuadrat
- __Persamaan melalui 3 titik
- __Gambar Grafik Kuadrat
- __Jenis Akar Persamaan
- __Hitung Akar Persamaan
- __Susunan Akar Kuadrat
- __Akar Kuadrat Rumus ABC
- __Cara Kuadrat Sempurna
- _Tips Trik Aljabar 1
- __Pemfaktoran ax2+bx+c
- __Hipotesis Kontinuum
- __Aljabar vs Kalk. vs Trig.
- __Konversi SPL ke Matriks
- __Polinomial & Pemfaktoran
- __Basis kernel Trans. Linear
- __Pers & Pertidak. Bertahap
- _Tips Trik Aljabar 2
- __Rms. Aljabar pangkat dua
- __Rms. Aljabar pangkat tiga
- __Pengurangan Aljabar
- __x linear 1 variabel
- __Trik perkalian Aljabar
- __Perpangkatan Aljabar
- __Bentuk-bentuk Aljabar
- _Pers. Garis Lurus
- __Gradien Garis & sifatnya
- __Persamaan Garis Sejajar
- __Persamaan Garis Tegak
- __Gradien Garis 2 Titik
- __Gradien Garis ax+by+c=0
- __Menentukan Persamaan
- __Pers. garis singgung kurva
- _Tips & Trik Pembagian
- __Pemb. Aljabar Bersusun
- __Pembagian Notasi Ilmiah
- __Tips & Trik Pembagian 99
- __Pembagian 5 jadi Desimal
- __Pembagian Akar Pangkat
- __Algoritma Pembagian
- __Pembagian Biner
- Studi1
- _Study Sains 1
- __Soal Bahasa Panda
- __Segitiga Trigonometri
- __Soal Aturan Sin-Cos
- __Kimia Hidrokarbon
- __Kimia Stoikiometri
- __Matematika Phytagoras
- __Fisika Kemagnetan
- _Study Sains 2
- __Kimia Nomenklatur
- __Bola Berhimpit Tabung
- __Fisika Fluida Dinamis
- __Matematika Matriks
- __Fisika Dinamika Rotasi
- __Fungsi Trigonometri
- __Selisih Lingkaran Sepusat
- _Study Sains 3
- __Volume & Luas Limas
- __Luas & Kel. Potong Juring
- __Sdt Pusat & Kel Lingkaran
- __Luas Gab. dua Tembereng
- __Matematika Vektor
- __Permukaan Kap Lampu
- __Bandul Kerucut Blh Bola
- _Study Sains 4
- __Sistem Organisasi Mahluk
- __Ls Segitiga Tanpa Tinggi
- __Matematika Notasi Sigma
- __Materi Logika Matematika
- __Hitung persegi & segitiga
- __Teori Gerak Newton
- __Segi Empat dan Segitiga
- _Study Sains 5
- __Peluang Probabilitas
- __Modus, Median, Rata2
- __ Persekutuan 2 Lingkaran
- __Garis Singgung 1 Titik
- __Luas Permukaan Bangun
- __Hitung Waktu Bersama
- __Ls Bangun Datar Gab.
- _Study Sains 6
- __Keliling Pot. Lingkaran
- __IPA Fisika Gravitasi
- __Kesesuaian Foto & Karton
- __Elektrolit & Reaksi Redoks
- __Jari2 Kerucut dari Juring
- __Rumus Limit Tak Hingga
- __Pecahan Berbeda Bentuk
- _Study Sains 7
- __Cari Akar Pangkat Tiga
- __Kesebangunan Trapesium
- __Kesebangunan Segitiga
- __Rata2 Gabungan & Selisih
- __Nilai Diagram Lingkaran
- __Hitung Akar Pangkat 2
- __Hitung Soal Benar/Salah
- Studi2
- _Studi Sains 8
- __Cari Akar Pangkat Tiga
- __hacovercosine exco
- __Kesebangunan Trapesium
- __Tangan Kanan Lorentz
- __Kesebangunan Segitiga
- __Rumus Cepat Trapesium
- __Rata2 Gabungan & Selisih
- _Studi Sains 9
- __Notasi Atom & Elektron
- __Nilai Diagram Lingkaran
- __Turunan Fungsi Aljabar
- __Hitung Akar Pangkat 2
- __Sifat Bilangan Berpangkat
- __Sudut Jarum Jam
- __Redoks Metode Oxidasi
- _Studi Sains 10
- __Perbandingan TIU CPNS
- __Pers. Diferensial Parsial
- __Bagian2 Lingkaran
- __Kalk. Peubah Banyak
- __Sifat2 Bil. Berpangkat
- __Stimulus Respon Indera
- __Operasi Hitung Akar
- _Studi Sains 11
- __Ansuran Pinjaman Bank
- __Tutorial Mikrotik 1
- __Fenotip F2 Monohibrida
- __Tutorial Mikrotik 2
- __E. Potensial Kinetik & Mek.
- __AMPHTMLCheatsheet
- __Ilusi Optik
- _Studi Sains 12
- __Servis Mainboard Laptop
- __Letak Bayangan Cermin
- __Kerusakan Umum Laptop
- __Resolving Ethnic Conflict
- __Memperbaiki LCD Laptop
- __Jenis-jenis Politik Indonesia
- __Mengetik Cepat 10 Jari
- _Studi Soal-soal OSN 1
- __Soal Sering Olimpiade
- __Olimpiade Matematika
- __OSN SMP Pecahan
- __Tadutima & Palindrom
- __OSN Matematika Prop.
- __OSN SMP Daerah Arsir
- __OSN Geometri Sebangun
- _Studi Soal-soal OSN 2
- __OSN SMP Bentuk Akar
- __OSN SMP Kombinatorika
- __OSN SMP Faktorial
- __OSN SMP Suhu & Kalor
- __OSN SMP Geometri
- __OSN SMP Luas Tenda
- __OSN SMP Deret Bilangan
- Matematika
- Fisika
- Kimia
- Biologi
Don't Miss
10/recent/ticker-posts
Pelajaran IPA Kimia MOLALITAS DAN FRAKSI MOL
Bimbel Jakarta Timur BJTV.eu
Juni 30, 2020
Molaritas adalah jumlah mol zat terlarut per liter larutan. Ini adalah pengukuran konsentrasi tertentu. Molaritas didefinisikan sebagai jumlah mol zat terlarut per satuan volume. Molaritas dilaporkan sebagai M (baca molar), yang merupakan mol zat terlarut/L larutan. Molaritas bergantung pada suhu karena volume kerapatan larutan biasanya berubah dengan suhu.
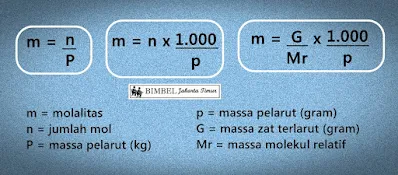
Molalitas adalah jumlah mol zat terlarut per kilogram pelarut. Pengukuran ini tidak bergantung pada suhu, karena massa tidak berubah dengan suhu. Satuannya dilambangkan dengan m, yang dibaca sebagai molal dan merupakan mol zat terlarut/kg pelarut.
Fraksi mol, seperti namanya, adalah perbandingan jumlah mol dalam larutan. Ini ditemukan dengan mengambil jumlah mol zat terlarut (atau pelarut) dibagi dengan jumlah total mol (zat terlarut + pelarut). Karena ini adalah pecahan, tidak ada satuan. Fraksi mol larutan harus berjumlah satu.
Mol adalah satuan SI dasar untuk mengukur jumlah zat. Satu mol terdiri dari sekitar 6,022 × 10^23 satuan dasar.
Mol adalah satuan yang sering digunakan dalam kimia. Reaksi kimia selalu disetarakan menggunakan mol reaktan dan produk. Konsentrasi larutan melibatkan mol zat terlarut. Beberapa contohnya adalah konsentrasi atau molaritas molar, molalitas, fraksi mol, kerapatan molar. Fraksi mol adalah cara lain untuk menyatakan konsentrasi.
Molalitas
Dalam larutan elektrolit adalah umum untuk membedakan antara pelarut (biasanya air) dan zat terlarut, atau zat terlarut, yang berdisosiasi menjadi ion. Untuk larutan-larutan ini, berguna untuk menyatakan komposisi dalam istilah molalitas, yang dinyatakan sebagai m, satuan yang sebanding dengan jumlah molekul zat terlarut yang tidak terdisosiasi (atau, sebagai alternatif, dengan jumlah ion) per 1.000 gram pelarut. Jumlah molekul atau ion dalam 1.000 gram pelarut biasanya sangat besar, sehingga molalitas didefinisikan sebagai jumlah mol per 1.000 gram pelarut.
Berikut adalah soal-soal dan Materi Pembahasan untuk membantu memahami perhitungan sifat-sifat tersebut.
Tag:
contoh soal fraksi mol
rumus molalitas dan contoh soal
pengertian molalitas
contoh soal molalitas dan fraksi mol
simbol fraksi mol
rumus fraksi mol
satuan fraksi mol
contoh soal fraksi mol
contoh soal fraksi mol beserta jawabannya
contoh soal molalitas
soal pilihan ganda molalitas
berikan 3 contoh perhitungan molalitas
cara mencari fraksi mol
cara menghitung molalitas
contoh soal molaritas beserta jawabannya

Diposting oleh Bimbel Jakarta Timur BJTV.eu
Bimbingan belajar Bimbel berlokasi di Jakarta Timur, BJTV.eu Tutorship Vista, Bimbel dengan Sistem Pembelajaran Adaptif Jakarta TimurAnda mungkin menyukai postingan ini
Tumblr
Tags
- Aljabar (3)
- Aritmatika (6)
- Bimbel Jakarta Timur (205)
- Bimbingan Belajar (1)
- Biologi (8)
- CPNS (6)
- Fisika (31)
- Geometri (5)
- Ilmu Pengetahuan (19)
- Inspirasi (8)
- instituteistic (3)
- IPA (52)
- Islami (6)
- Kimia (11)
- Matematika (133)
- Metode (10)
- PAT PAS UAS (9)
- PAT/PAS/UAS (10)
- Pemrograman (4)
- Pengukuran (1)
- Radarhot com (11)
- SD (29)
- SMA (50)
- SMP (57)
- Soal (27)
- Trigonometri (2)
- Tutorial (3)
- UN/UNBK/USBN (4)
- UTS/PTS (6)
- video (12)
Categories
- Aljabar (3)
- Aritmatika (6)
- Bimbel Jakarta Timur (205)
- Bimbingan Belajar (1)
- Biologi (8)
- CPNS (6)
- Fisika (31)
- Geometri (5)
- Ilmu Pengetahuan (19)
- Inspirasi (8)
- instituteistic (3)
- IPA (52)
- Islami (6)
- Kimia (11)
- Matematika (133)
- Metode (10)
- PAT PAS UAS (9)
- PAT/PAS/UAS (10)
- Pemrograman (4)
- Pengukuran (1)
- Radarhot com (11)
- SD (29)
- SMA (50)
- SMP (57)
- Soal (27)
- Trigonometri (2)
- Tutorial (3)
- UN/UNBK/USBN (4)
- UTS/PTS (6)
- video (12)
Tutorship Vista
Tutorship Vista

4 stars -
based on 250 reviews
Email: dkusumastuti76@gmail.com
Phone: +62895322288565
Url: www.radarhot.com
Hours:
Sat-Sun 08:00am - 17:30pm
Mon-Fri 08:00am - 20:30pm
Sat-Sun 08:00am - 17:30pm
Mon-Fri 08:00am - 20:30pm
Cash
Jl. Wijaya Kusuma I, Durensawit, Malaka Sari
Jakarta, Jakarta Indonesia 13460
ID
IDR500000
Tutorship Vista Bimbingan Belajar Sistem Pembelajaran Adaptif Soal Matematika IPA Fisika Kimia Biologi SD SMP SMA
Tutorship Vista
Institute Pertanian Bogor



0 Komentar